Введение
Широкое понятие дефекта молочной железы можно определить как нарушение нормальной анатомии молочной железы в виде дефицита одной из структурных составляющих: наполнителя и/или покровных тканей, крайней степенью которого является ее отсутствие. Причиной дефекта молочной железы могут быть как врожденные состояния, так и приобретенные факторы, среди которых на первом месте стоит удаление молочной железы и прилежащих тканей по поводу злокачественного новообразования.
Восстановление молочной железы возможно путем привнесения пластического материала: собственных тканей, представленных различными видами аутотрансплантатов (свободных, ротированных), и современных синтетических материалов (различные имплантаты, ацеллюлярные матриксы); а также сочетанием и тех, и других. Выбор метода при восстановлении молочной железы соотносится с параметрами здоровой молочной железы и тем эстетическим результатом, который мы хотим получить, учитывая, что молочная железа парная часть тела.
Наш опыт реконструкции молочной железы составляет 96 наблюдений, из них в 64 наблюдениях нами была выполнена реконструкция молочной железы после ее удаления из-за онкологического процесса. На основании полученного опыта мы суммировали факторы, которые нужно учитывать при выборе метода реконструкции молочной железы: 1) конституциональный тип пациентки, размер контрлатеральной молочной железы; 2) состояние грудной стенки, наличие рубцовой деформации; 3) наличие или отсутствие большой грудной мышцы; 4) состояние потенциальных донорских областей, в частности, наличие избытка тканей передней брюшной стенки; 5) отношение пациентки к использованию имплантатов; 6) индивидуальные пожелания пациентки.
Получение желаемого результата, – формирование молочной железы, максимально приближенной к естественной по форме и консистенции, -процесс многоэтапный, зависящий от желания пациентки и ее настроя на максимально возможный результат. Основными этапами реконструкции молочной железы могут выступать следующие: 1) восстановление объёма и формы молочной железы; 2) устранение мягкотканных дефектов передней стенки грудной клетки; 3) коррекция формы и объёма контрлатеральной молочной железы; 4) формирование сосково-ареолярного комплекса. Этапы реконструкции могут выполняться одномоментно или последовательно, дополняя друг друга в зависимости от клинической ситуации.
Система выбора вторичной реконструкции молочной железы после мастэктомии, которой мы придерживаемся при выборе метода реконструкции, опирается преимущественно на особенности дефекта. (Рис. №1).
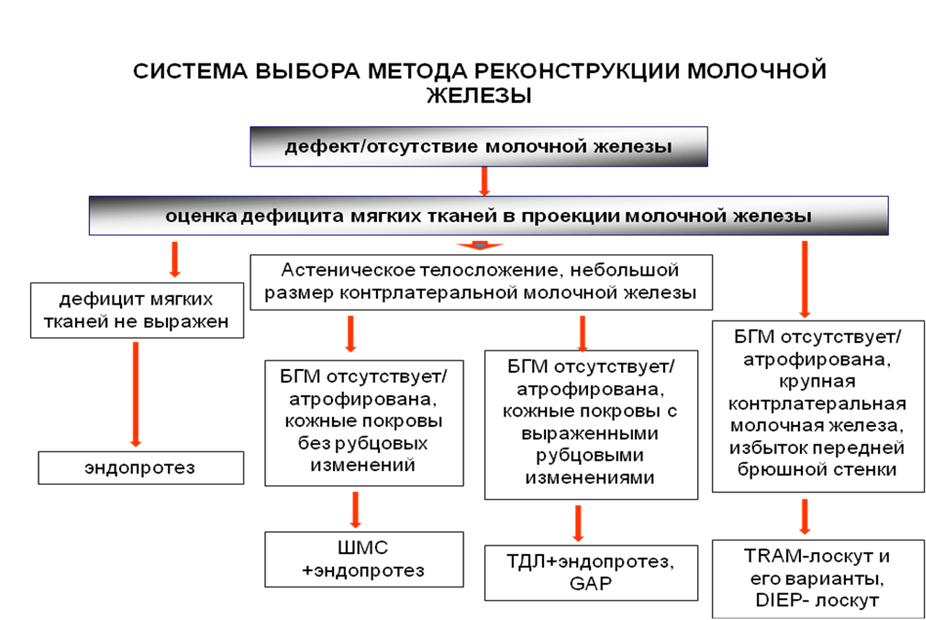
Рис. №1. Схема системы выбора метода реконструкции молочной железы. БГМ – большая грудная мышца, ШМС – широчайшая мышца спины, ТДЛ – торакодорсальный аутотрансплантат, GAP – аутотрансплантат на основе перфоранты ягодячной артерии, TRAM- поперечный лоскут живота на основе прямой мышцы, DIEP – аутотрансплантат на основе перфоранты нижней эпигастральной артерии.
При сохранной большой грудной мышце возможно проведение реконструкции молочной железы с использованием только имплантата. В зависимости от состояния мягких тканей, реконструкцию можно осуществить в один этап, используя имплантат стабильной формы. При дефиците кожи необходимо ее растяжение или с помощью протеза-экспандера Беккера (одномоментная реконструкция), или с помощью обычного экспандера с последующей его заменой на эндопротез (двухэтапная реконструкция).
При наличии дефектов, связанных с отсутствием большой грудной мышцы, получить хороший результат реконструкции путем использования только имплантатов невозможно. Ротация ШМС позволяет заместить большую грудную мышцу. Для восполнения объема железы необходимы имплантаты, используемые либо одномоментно, либо в два этапа (экспандер, заменяемый эндопротезом молочной железы). При дефиците кожного компонента возможна ротация ШМС с кожными покровами, размеры которого зависят от размера дефекта кожи (использование ТДЛ).
Наиболее рациональным и часто используемым пластическим материалом для реконструкции молочной железы является аутотрансплантат на основе прямой мышцы живота (TRAM - кожно-мышечным поперечный лоскут прямой мышцы живота), свободный микрохирургический или ротированный на мышечной ножке. Основными недостатками данного аутотрансплантата являются необходимость наличия избытка мягких тканей живота, а также дефект передней брюшной стенки, возникающий после забора мышечного компонента (прямой мышцы живота). Данный дефект не всегда удается компенсировать сетчатыми имплантатами, что приводит к формированию грыж и деформаций передней брюшной стенки и необходимости повторных операций.
На сегодняшний день альтернативу TRAM- аутотрансплантатам составляют микрохирургические аутотрансплантаты на основе перфорантных сосудов. В частности, DIEAP (deep inferior epigastric artery perforator flap) – кожно-жировой аутотрансплантат на основе перфорантных сосудов нижней эпигастральной артерии.
Особенности микрохирургического DIEP аутотрансплантата для реконструкции молочной железы.
Перфорантный аутотрансплантат нижней глубокой надчревной артерии был впервые описан в 1989 году Koshima и Soeda. В 1994 году Allen и Treece описали его в контексте реконструкции груди при лечении постмастэктомического синдрома. Перфорантный аутотрансплантат нижней глубокой надчревной артерии обладает явными преимуществами для пациента по сравнению с TRAM- аутотрансплантатом: снижение урона наносимого донорской области и более короткий период реабилитации. Перфорантный аутотрансплантат нижней глубокой надчревной артерии имеет высокие показатели надежности и низкую частоту осложнений (Gill PS, et al. 2004; Granzow JW, Levine JL, et al. 2005; Hamdi M, Rebecca A., 2006), однако забор аутотрансплантата требует высокого уровня хирургической техники и значительной подготовки.
Зоны перфузии перфорантов глубокой нижней эпигастральной артерии широко изучены, как в клинических, так и в анатомических исследованиях. На основании данных исследований были четко определены наиболее надежно кровоснабжаемые участки тканей передней брюшной стенки. Все эти зоны образуют ангиосом, участок кожи кровоснабжаемый всеми перфорантами ипсилатеральной эпигастральной артерии. Прямое применение данной концепции невозможно в связи с тем, что при заборе аутотрансплантата используются не все существующие перфорантные сосуды, часто хирурги предпочитают выбирать один наиболее крупный перфорантный сосуд. В этом случае первичная зона перфузии ограничена ветвями единственного перфорантного сосуда, и смежные перфоросомы будут наполняться посредством анастомозирования через резистивные сосуды. Из четырех зон перфузии передней брюшной стенки, зона I имеет максимальную перфузию от ипсилатеральной глубокой нижней эпигастральной артерии (Рис. №2).

Рис. №2. Схема зон перфузии передней брюшной стенки в зависимости от ряда перфорантов: слева – медиальный; справа – латеральный (Rozen WM, Ashton MW et al., 2010).
Среди противопоказаний к использованию DIEP-аутотрансплантата отмечают ранее выполненные абдоминопластики или липосакции области живот, множественные рубцы на животе, а также активное курение (Giunta R.E., Geisweid A., Feller A.M., 2000). В качестве предоперационного исследования перфорантных сосудов используют УЗИ сосудов, однако оно дает большое число ложно-положительных результатов. Компьютерная томография с контрастированием обладает высокой чувствительностью для определения точек выхода перфорантных сосудов. (Alonso-Burgos A. et al., 2006; Masia J., Clavero J.A. et al., 2006).
Технические аспекты реконструкции молочной железы
с использованием DIEAP аутотрансплантата.
Перед операцией производят разметку аутотрансплантата аналогично разметке при абдоминопластике: ширина лоскута по срединной линии от 12 до 18 см, латерально аутотрансплантат ограничен верхними передними остями подвздошных костей (Рис. №3).
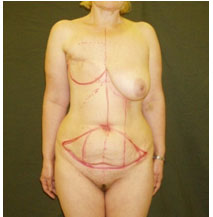
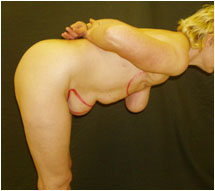
А. Б.
Рис. №3. Предоперационная разметка пред использованием DIEAP- аутотрансплантата для реконструкции молочной железы. А – вид спереди, Б – вид сбоку.
Операция выполняют двумя бригадами хирургов. Целесообразно выделять сосудистую ножку на контралатеральной стороне аутотрансплантата относительно реконструируемой молочной железы. Это способствует в дальнейшем такой ориентации аутотрансплантата, при которой более толстый центральный жировой слой используется для формирования нижнего склона реконструируемой железы. После нижнего и верхнего разрезов кожи сначала выделяют поверхностные нижние эпигастральные сосуды. При достаточном диаметре поверхностной нижней эпигастральной вены она может быть сохранена в качестве запасной, в случае венозного застоя после анастомоза с глубокой нижней эпигастральной веной. Далее аутотрансплантат препарируют в медиальном направлении. Перфорантный аутотрансплантат глубокой нижней эпигастральной артерии может быть взят на нескольких перфорантах из одного ряда (латеральный или медиальный) с атравматичным продольным разделением волокон прямой мышцы живота. Если подходящий перфорантный сосуд не найден, то диссекцию продолжают на контралатеральной стороне. После выбора подходящего перфорантного сосуда производят препарирование последнего посредством диссекции влагалища прямой мышцы живота, разделения межмышечных волокон и лигирования внутримышечных сосудистых веточек (Рис. №4 а,б).
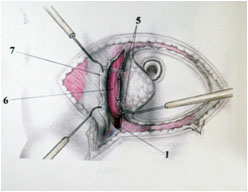
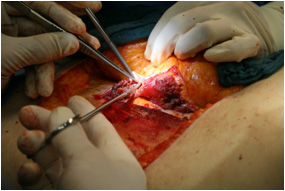
А. Б.
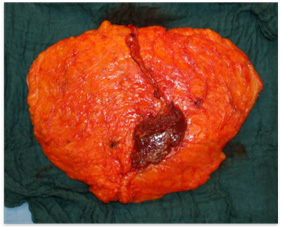
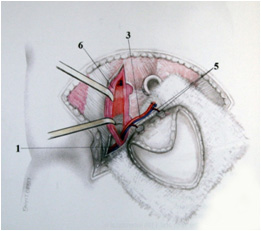
В. Г.
Рис. №4. Этапы забора DIEAP-аутотрансплантата. А,Г – схемы этапов забора DIEAP аутотрансплантата (B.Strauch, Han-Liang Yu. 2005), б – выделение перфорантного сосуда с атравматичным разведением волокон интраоперационно. В – аутотрансплантат готов к трансплантации.
Поддержание сухого операционного поля имеет решающее значение для безопасного выделения перфорантного аутотрансплантата глубокой нижней эпигастральной артерии, что актуально для техники забора всех перфорантных аутотрансплантатов. Необходимо сохранить в целостности сегментарные межреберные нервы, идущие в медиальном направлении, поверхностно относительно сосудистой ножки. Диссекцию сосудов продолжают до тех пор, пока длина и диаметр сосудистой ножки не будет достаточной.
Перфорантные аутотрансплантаты – свободные микрохирургические, для них большое значение имеет наличие стабильных реципиентных сосудов. У онкологических пациентов после мастэктомии сосуды в подмышечной области нередко скомпрометированы, что во многом определяет использование TRAM аутотрансплантата чаще в виде ротированного варианта. Поиск более стабильных по анатомии и менее подверженных повреждению во время лечения рака молочных желез сосудов, привел к широкому использованию внутренней грудной артерии и вены в качестве реципиентных сосудов при реконструкции молочной железы. При наличии крупных перфорантных ветвей от внутренней грудной артерии они могут быть использованы для наложения анастомоза (что возможно при первичной реконструкции); в противном случае внутренние грудные сосуды выделяются в третьем межреберном промежутке либо для доступа к сосудам резецируется третий реберный хрящ. Следующим этапом производят реваскуляризацию аутотрансплантата через внутренние грудные артерию и вену с использованием микрохирургической техники (Рис. №5 а,б).
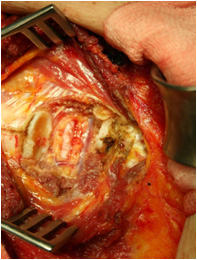
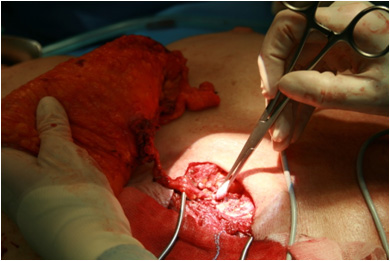
А. Б.
Рис. №5. Этапы операции в реципиентной зоне. А – внутригрудные артерия и вена выделены в области третьего ребра (реберный хрящ резецирован на протяжении 4 см), Б - DIEAP аутотрансплантат реваскуляризирован.
На завершающем этапе производят моделирование лоскута в соответствии с параметрами дефекта молочной железы. В зависимости от количества сохраненной кожи в реципиентной области выполняют деэпидермизацию кожи лоскута. IV зона аутотрансплантата обычно резецируют.
Клиническое наблюдение.
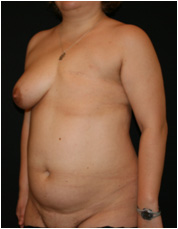
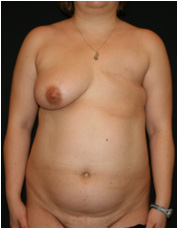
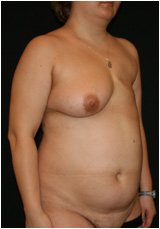
Пациентка Ф. поступила с жалобами на неудовлетворительный внешний вид грудной стенки, отсутствие левой молочной железы вследствие перенесенной мастэктомии по поводу рака молочной железы (Рис. №7).
A Б В
Рис. №6. Пациентка Ф. Диагноз: ПМЭС. состояние после мастэктомии по Маддену (эстроген-зависимая опухоль левой молочной железы: T2N1M0). Внешний вид до операции в трех проекциях. А – левая полубоковая, Б– прямая, В – правая полубоковая проекции.
Диагноз: ПМЭС. состояние после мастэктомии по Маддену (эстроген-зависимая опухоль левой молочной железы: T2N1M0). Было проведено 4 курса химиотерапии. Лучевая терапия не проводилась. На момент операции получала гормональную терапию: тамоксифен, золодекс. При осмотре: слева молочная железа отсутствует, на коже определяется нормотрофический послеоперационный рубец длиной 16 см. Дефицит подкожно-жировой клетчатки в латеральной области грудной стенки. Регионарные лимфоузлы не увеличены. Справа молочная железа соответствует размеру «С», кожа над ней чистая, нормальной влажности и толщины, птоз 2 степени. При пальпации патологических узлов не отмечается.
Предоперационный протокол включал в себя ультразвуковую допплерографию и допплерометрию сосудов донорской зоны, а также компьютерную томографию с ангиоконтрастированием с целью определения точек прободения перфорантными сосудами глубокой фасции, нанесение предоперационной разметки (Рис. №7).
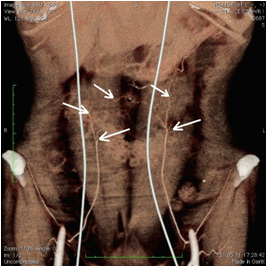
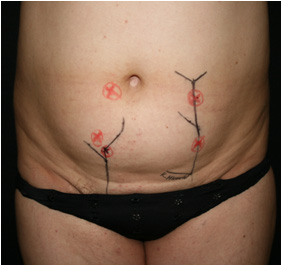
А. Б.
Рис. №7. Предоперационный протокол исследования. А - компьютерная томография с ангио-контрастированием, Б -предоперационная разметка.
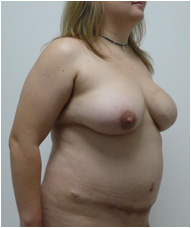
Пациентке была выполнена операция: реконструкция молочной железы свободным микрохирургическим DIEAP аутотрансплантатом. Швы сняты на 12-14 сутки после операции. Рана донорской области зажила первичным натяжением. Пациентка была активизирована на вторые сутки послеоперационного периода (Рис. №8). Пациентке планируется создание сосково-ареолярного комплекса и коррекция послеоперационного рубца.
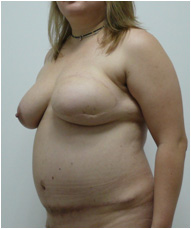
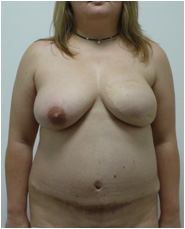
А. Б. В
Рис. №8. Пациентка Ф. Диагноз: ПМЭС. состояние после мастэктомии по Маддену (эстроген-зависимая опухоль левой молочной железы: T2N1M0). Вид пациентки через 1 год после операции реконструкции молочной железы свободным микрохирургическим DIEAP аутотрансплантатом в трех проекциях. А – левая полубоковая, б – прямая, в – правая полубоковая проекции.
Обсуждение.
Методы реконструкции груди разнообразны и каждый имеет свои достоинства, показания к использованию и альтернативу. Вторичная реконструкция груди обладает рядом особенностей, основная из которых заключается в необходимости привнесения в обязательном порядке мягких тканей путем перемещения кожных и кожно-мышечных аутотрансплантатов.
На сегодняшний день большую популярность приобрели перфорантные свободные микрохирургические аутотрансплантаты, среди которых DIEAP лоскут для реконструкции груди. Прежде всего, он конкурирует с аутотрансплантатами передней стенки живота (свободный TRAM и TRAM, ротированный на мышечной ножке). Основное достоинство данного аутотрансплантата в том, что при его заборе сохраняется прямая мышца живота. При соблюдении технологии операции забор аутотрансплантата приравнивается к абдоминопластике. К достоинствам аутотрансплантата следует также отнести стабильность сосудистой ножки. Среди недостатков методики – все риски, сопряженные с микрохирургией и необходимость владения микрохирургической техникой.
Из сравнительных исследований аутотрансплантатов передней брюшной стенки наибольшее внимание на сегодняшний день заслуживает работа LI-Xing Man et al., (2009), который осуществил систематизацию данных, опубликованных хирургами по сравнению DIEAP аутотрансплантата и свободного(FREE) TRAM-аутотрансплантата (сохраняется часть m.rectus по сравнению с классическим TRAM- аутотрансплантатом). Среди 37 анализируемых публикаций, в 6 статьях сравнивали DIEAP (330 аутотрансплантатов) и FREE-TRAM (841 аутотрансплантатов), а в 30 работах анализировали лоскуты отдельно: DIEAP аутотрансплантат (18 статей – 1920 аутотрансплантатов/1614 пациентов) и FREE-TRAM аутотрансплантат (12 статей – 3185 аутотрансплантатов/2645 пациентов). В структуру осложнений были включены: 1)жировой некроз аутотрансплантата; 2)частичный некроз аутотрансплантата; 3)полная потеря аутотрансплантата; 4)слабость/пролапс/выбухание передней брюшной стенки; 5)истинные грыжи передней брюшной стенки. Результатом столь основательного мета анализа стали следующие данные: жировой некроз чаще наблюдался при использовании DIEAP аутотрансплантата (10,6% при статистической достоверности в 95% против 4,9% для FREE-TRAM аутотрансплантата при той же статистической достоверности); частота потери лоскута DIEAP также практически вдвое больше, чем потеря FREE-TRAM аутотрансплантата (2,0% при 95% статистической достоверности для DIEAP против 1,0% при 95% статистической достоверности для FREE-TRAM). Авторы утверждают, что частота тотальной потери одинакова для обоих аутотрансплантатов, что, по-видимому, связано с дефектами анастомозов и хирургической техникой. При этом частота слабости передней брюшной стенки была существенно выше при использовании FREE-TRAM (5,9% против 3,1% ), чем DIEAP. Различия более чем в 3,5 раза были обнаружены по частоте образования послеоперационных грыж, так в случае DIEAP истинные грыжи были диагностированы у 0,8% пациентов, по сравнению с 3,9% при использовании FREE-TRAM аутотрансплантата.
Авторы отмечают, что частота полной потери аутотрансплантата снижалась при накоплении опыта, по сравнению с неизменными значениями абдоминальных осложнений.
Таким образом, не существует одной уникальной и единственно верной методики для вторичной реконструкции молочной железы. Многое зависит не только от хирургического мастерства, но и от анатомических особенностей пациентки. Так при близком расположении перфорантных сосудов и сложности выделения и/или травматичности в отношении мышцы, мы интраоперационно можем сменить тактику и вместо DIEAP аутотрансплантата забрать FREE-TRAM, принеся в жертву анатомическую целостность передней поверхности брюшной стенки меньшему риску осложнений со стороны лоскута.
Конечная цель реконструктивных операций - воссоздать молочную железу максимально близкую к контралатеральной, имеющую естественный вид; при этом минимизировав кратность хирургических вмешательств. Выбор метода реконструкции всегда должен быть в балансе между навыками и авантюризмом хирурга и исходными параметрами и пожеланиями пациентки. В арсенале хирурга, занимающегося реконструкцией молочной железы, должно быть несколько методов, что позволит осуществить индивидуальный подход к каждой пациентке.
СПИСОК ЛИТЕРАТУРЫ
- Allen RJ, Treece P. Deep inferior epigastricperforator flap for breast reconstruction. Ann. Plast. Surg. 1994; 32:32–38.
- Alonso-Burgos A, Garcia-Tutor E, Bastarrika G, Cano D, Martinez-Cuesta A, Pina LJ. Preoperative planning of deep inferior epigastric artery perforator flap reconstruction with multislice-CT angiography: Imaging findings and initial experience. J. Plast.Reconstr.Aesthet. Surg. 2006; 59:585–593.
- Gill PS, Hunt JP, Guerra AB, et al. A 10-year retrospective review of 758 DIEP flaps for breast reconstruction. Plast.Reconstr. Surg. 2004; 113:1153–1160.
- Gill PS, Hunt JP, Guerra AB, et al. A 10-year retrospective review of 758 DIEP flaps for breast reconstruction. Plast.Reconstr. Surg. 2004; 113:1153–1160.
- Giunta RE, Geisweid A, Feller AM. The value of preoperative Doppler sonography for planning free perforator flaps. Plast.Reconstr. Surg. 2000; 105:2381–2386.
- Granzow JW, Levine JL, Chiu ES, Allen RJ. Breast reconstruction with the deep inferior epigastric perforator flap: History and an update on current technique. J. Plast.Reconstr.Aesthet. Surg.
- Hamdi M, Rebecca A. The deep inferior epigastric artery perforator flap (DIEAP) in breast reconstruction. Semin.Plast. Surg. 2006; 20:95–102.2006; 59:571–579.
- Koshima I, Soeda S. Inferior epigastric artery skin flap without rectus abdominis muscle. Br J Plast Surg. 1989; 42:645–648.
- Li Xing Man, Jesse C. Celber., Joseph M. Srletti. Abdominal Wall Following Free TRAM or DIEP flap reconstruction: A Meta-Analysis and Critical Review. Plastic and Reconstructive Surgery 2009; 124(3):752 - 764
- Masia J, Clavero JA, Larranaga JR, et al. Multidetector-row computed tomography in the planning of abdominal perforator flaps. J. Plast.Reconstr.Aesthet. Surg. 2006; 59:594–599.
- Offman SL, Geddes CR, Tang M, Morris SF. The vascular basis of perforator flaps based on the source arteries of the lateral lumbar region. Plast.Reconstr. Surg. 2005; 115:1651– 1659.
- Rozen WM, Ashton MW, Le Roux CM, Pan WR, Corlett RJ. The perforator angiosome: A new concept in the design of deep inferior epigastric artery perforator flaps for breast reconstruction. Microsurgery 2010; 30: 1–7.
Отзывы
Все отзывы »